Descobreixen a escala atòmica la comporta neuronal per a molècules essencials en l’aprenentatge i la memòria
Aprendre d’una experiència, recordar una anècdota o modificar una actitud són exemples que revelen com tot el nostre comportament és el resultat de l’intercanvi de compostos químics —els neurotransmissors— entre neurones. Desentranyar què passa exactament a escala molecular quan les neurones parlen entre si a les sinapsis és decisiu per entendre el cervell humà en general i, en particular, per contribuir a solucionar problemes de salut mental.

Aprendre d’una experiència, recordar una anècdota o modificar una actitud són exemples que revelen com tot el nostre comportament és el resultat de l’intercanvi de compostos químics —els neurotransmissors— entre neurones. Desentranyar què passa exactament a escala molecular quan les neurones parlen entre si a les sinapsis és decisiu per entendre el cervell humà en general i, en particular, per contribuir a solucionar problemes de salut mental.
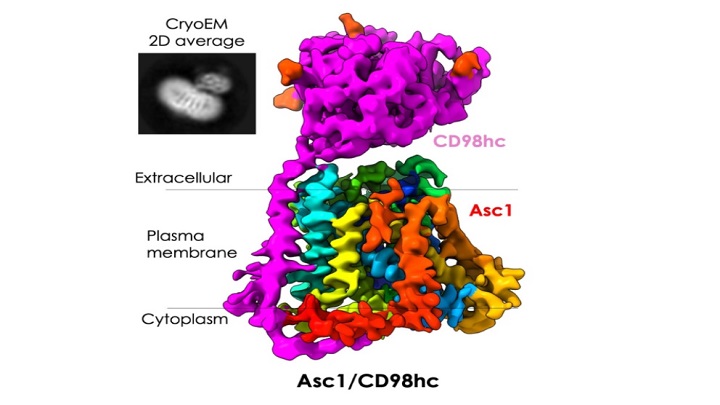
Ara, un nou estudi ha permès observar i descriure l’estructura d’una proteïna present a la membrana de les neurones que actua com una comporta que s’obre i es tanca. És la proteïna Asc1/CD98hc —Asc1 en la forma abreujada—, que actua com a transportador específic per a determinats aminoàcids clau per a l’aprenentatge i la memòria.
L’article, publicat a la revista Nature Communications, és dirigit per equips de la Universitat de Barcelona (UB), l’Institut de Recerca Biomèdica (IRB Barcelona), el Centre Nacional d’Investigacions Oncològiques (CNIO) i el Centre de Recerca Biomèdica a la Xarxa de Malalties Rares (CIBERER).
Una proteïna relacionada amb malalties mentals
L’activitat de la proteïna Asc-1 s’ha relacionat amb diferents tipus de patologies mentals. Per això, conèixer-ne l’estructura tridimensional permetrà desenvolupar de nous fàrmacs per a aquestes patologies.
«Modular l’activitat de l’Asc-1 pot ser una estratègia terapèutica en afeccions com l’ictus i l’esquizofrènia. La determinació de l’estructura de l’Asc-1 a la resolució atòmica és important perquè pot ajudar a la recerca de compostos que modifiquin la seva activitat», detalla l’expert Óscar Llorca (CNIO).
«La col·laboració entre la UB, l’IRB Barcelona i el CNIO ha estat clau per desentranyar els misteris de l’Asc-1 i obtenir una visió sense precedents de la seva estructura i el seu funcionament. La descoberta no només aporta llum a la complexa maquinària cel·lular subjacent a processos cognitius fonamentals, sinó que també ens apropa al desenvolupament d’intervencions terapèutiques més precises per a una gamma de trastorns neurològics», afegeix Manuel Palacín, catedràtic del Departament de Bioquímica i Biomedicina Molecular de la Facultat de Biologia i cap del Laboratori de Transportadors d’Aminoàcids i Malaltia de l’IRB Barcelona.
A més dels experts Óscar Llorca i Manuel Palacín, en el treball també destaca la participació d’Ekaitz Errasti-Murugarren, professor del Departament de Ciències Fisiològiques de la Facultat de Medicina i Ciències de la Salut de la UB. Els primers signants són Josep Rullo-Tubau (IRB Barcelona) i María Martínez-Molledo (CNIO).
Transportar molècules decisives per a les funcions cognitives
Totes les cèl·lules de l’organisme tenen a la membrana unes comportes per intercanviar substàncies amb el medi exterior. Es tracta de proteïnes que estan obrint-se i tancant-se de manera contínua segons les necessitats de la cèl·lula. En concret, s’obren cap a l’interior, capturen molècules —per exemple, un aminoàcid— amb una modificació en la seva estructura, les alliberen i s’obren cap a l’exterior, o viceversa.
La proteïna Asc-1 es troba principalment a les neurones de l’hipocamp i l’escorça cerebral, al cervell. Està especialitzada a introduir o bé treure de la neurona dos aminoàcids fonamentals —en concret, D-serina i glicina— per a les connexions neuronals —les sinapsis— implicades en l’aprenentatge, la memòria i la plasticitat cerebral, que és la capacitat del sistema nerviós de modificar els circuits en resposta a nous entorns.
Les fluctuacions en el subministrament d’aquests aminoàcids s’han associat a l’esquizofrènia, els infarts cerebrals, l’ELA i altres malalties neurològiques. Fa temps que s’intenta dissenyar fàrmacs que regulin l’activitat de l’Asc-1 per tractar aquestes malalties, però sense èxit. Conèixer detalladament l’estructura atòmica de l’Asc-1 aporta informació essencial per aconseguir-ho.
Caçada quan s’obria cap a l’interior
La proteïna Asc-1 va ser purificada per l’expert Josep Rullo-Tubau a l’IRB Barcelona, i transferida al CNIO perquè María Martínez-Molledo la pogués observar amb criomicroscòpia electrònica i, així, determinar l’estructura de l’Asc-1 en 3D i alta resolució mitjançant aquestes imatges. Amb la tècnica de la criomicroscòpia electrònica, les molècules es congelen a alta velocitat i s’observen en microscopis electrònics. Posteriorment, s’utilitzen tècniques d’imatge avançades per interpretar la informació.
L’estructura observada mostra l’Asc-1 quan ha estat atrapada en un estadi en què la comporta estava oberta cap a l’interior de la cèl·lula, just quan esperava rebre un aminoàcid per ser transportat. «A partir de la seva estructura atòmica, vam poder predir quines parts de la proteïna semblen importants per unir l’aminoàcid que serà transportat, i el possible mecanisme per transportar-lo cap a l’exterior de la cèl·lula», afirma Llorca.
Els grups dels experts Víctor Guallar (Centre de Supercomputació de Barcelona) i Lucía Díaz (Nostrum Biodiscovery) van fer aquestes prediccions sobre el funcionament del transportador que van ser testades per Rullo-Tubau, mitjançant el mesurament de l’efecte de mutacions específiques a l’Asc-1. Aquests treballs van ser complementats per Rafael Artuch (Hospital Sant Joan de Déu) i la plataforma científica de Bioestadística i Bioinformàtica de l’IRB Barcelona, que lidera Camille Stephan-Otto Attolini.
Una proteïna amb dos modus operandi
Les conclusions contribueixen a explicar una altra particularitat de l’Asc-1. Si bé la resta de la família de transportadors a què pertany —anomenada HAT— només poden intercanviar aminoàcids —és a dir, transportar un aminoàcid cap a dins de la cèl·lula quan en treuen un altre o viceversa—, l’Asc-1 és capaç d’extreure un aminoàcid sense necessitat d’introduir-ne un altre i obrir-se i tancar-se de buit. Aquest mode d’activitat s’anomena difusió.
Els resultats obtinguts sobre l’estructura molecular de l’Asc-1 aporten dades per comprendre millor la funció que fa cadascun dels modes de transport. El finançament del nou estudi procedeix majoritàriament de la Fundació ”la Caixa” i el Ministeri de Ciència, Innovació i Universitats («Implicació en malalties neurològiques»).
Article de referència:
Rullo-Tubau, Josep; Martínez-Molledo, Maria et al. «Structure and mechanisms of transport of human Asc1/CD98hc amino acid transporter». Nature Communications, abril de 2024. Doi: 10.1038/s41467-024-47385-3.
Galeria multimèdia

D'esquerra a dreta, els investigadors Manuel Palacín, Josep Rullo-Tubau i Paola Bartoccioni.