Descubren a escala atómica la compuerta neuronal para moléculas esenciales en el aprendizaje y la memoria
Aprender de una experiencia, recordar una anécdota o cambiar una actitud son ejemplos que revelan cómo todo nuestro comportamiento es el resultado del intercambio de compuestos químicos —los neurotransmisores— entre neuronas. Desentrañar qué ocurre exactamente a escala molecular cuando las neuronas «hablan» entre sí en las sinapsis es decisivo para entender el cerebro humano en general y, en particular, para contribuir a solucionar problemas de salud mental.

Aprender de una experiencia, recordar una anécdota o cambiar una actitud son ejemplos que revelan cómo todo nuestro comportamiento es el resultado del intercambio de compuestos químicos —los neurotransmisores— entre neuronas. Desentrañar qué ocurre exactamente a escala molecular cuando las neuronas «hablan» entre sí en las sinapsis es decisivo para entender el cerebro humano en general y, en particular, para contribuir a solucionar problemas de salud mental.
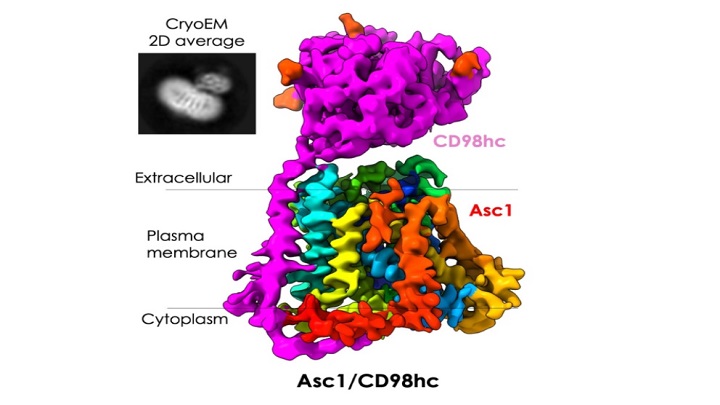
Ahora, un estudio ha observado y descrito la estructura de una proteína presente en la membrana de las neuronas que actúa como una compuerta que se abre y cierra. Es la proteína Asc1/CD98hc (Asc1 en la forma abreviada), que actúa como transportador específico para determinados aminoácidos clave para el aprendizaje y la memoria.
El artículo, publicado en la revista Nature Communications, lo han dirigido equipos de la Universidad de Barcelona (UB), el Instituto de Investigación Biomédica (IRB Barcelona), el Centro Nacional de Investigaciones Oncológicas (CNIO) y el Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER).
Una proteína relacionada con enfermedades mentales
La actividad de la proteína Asc-1 se ha relacionado con distintos tipos de patologías mentales. Por eso, conocer su estructura tridimensional permitirá desarrollar nuevos fármacos para estas patologías.
«Modular la actividad del Asc-1 puede ser una estrategia terapéutica en afecciones como el ictus y la esquizofrenia. La determinación de la estructura del Asc-1 en la resolución atómica es importante porque puede ayudar a la búsqueda de compuestos que modifiquen su actividad», detalla el experto Óscar Llorca (CNIO).
«La colaboración entre la UB, el IRB Barcelona y el CNIO ha sido clave para desentrañar los misterios de la Asc-1 y obtener una visión sin precedentes de su estructura y funcionamiento. El descubrimiento no solo aporta luz a la compleja maquinaria celular subyacente a procesos cognitivos fundamentales, sino que también nos acerca al desarrollo de intervenciones terapéuticas más precisas para una gama de trastornos neurológicos», añade Manuel Palacín, catedrático del Departamento de Bioquímica y Biomedicina Molecular de la Facultad de Biología de la UB y jefe del Laboratorio de Transportadores de Aminoácidos y Enfermedad del IRB Barcelona.
Además de los expertos Óscar Llorca y Manuel Palacín, en el trabajo también destaca la participación de Ekaitz Errasti-Murugarren, profesor del Departamento de Ciencias Fisiológicas de la Facultad de Medicina y Ciencias de la Salud de la UB. Los primeros firmantes son Josep Rullo-Tubau (IRB Barcelona) y María Martínez-Molledo (CNIO).
Transportar moléculas decisivas para las funciones cognitives
Todas las células del organismo tienen en la membrana unas compuertas para intercambiar sustancias con el medio exterior. Se trata de proteínas que se abren y cierran de forma continua según las necesidades de la célula. En concreto, se abren hacia el interior, capturan moléculas —por ejemplo, un aminoácido— con una modificación en su estructura, las liberan y se abren hacia el exterior, o viceversa.
La proteína Asc-1 se encuentra principalmente en las neuronas del hipocampo y la corteza cerebral, en el cerebro. Está especializada en introducir o sacar de la neurona dos aminoácidos fundamentales —en concreto, D-serina y glicina— para las conexiones neuronales —las sinapsis— implicadas en el aprendizaje, la memoria y la plasticidad cerebral, que es la capacidad del sistema nervioso de modificar los circuitos en respuesta a nuevos entornos.
Las fluctuaciones en el suministro de estos aminoácidos se han asociado a la esquizofrenia, los infartos cerebrales, la ELA y otras enfermedades neurológicas. Hace tiempo que se intenta diseñar fármacos que regulen la actividad del Asc-1 para tratar estas enfermedades, pero sin éxito. Conocer detalladamente la estructura atómica del Asc-1 aporta información esencial para conseguirlo.
Cazada cuando se abría hacia el interior
La proteína Asc-1 fue purificada por el experto Josep Rullo-Tubau en el IRB Barcelona, y transferida al CNIO para que María Martínez-Molledo la pudiera observar con criomicroscopia electrónica y, así, determinar la estructura del Asc-1 en 3D y alta resolución mediante estas imágenes. Con la técnica de la criomicroscopia electrónica, las moléculas se congelan a alta velocidad y se observan en microscopios electrónicos. Posteriormente, se utilizan técnicas de imagen avanzadas para interpretar la información.
La estructura observada muestra el Asc-1 cuando ha sido atrapada en un estadio en el que la compuerta estaba abierta hacia el interior de la célula, justo cuando esperaba recibir un aminoácido para ser transportado. «A partir de su estructura atómica, pudimos predecir qué partes de la proteína parecen importantes para unir el aminoácido que va a ser transportado, y el posible mecanismo para transportarlo hacia el exterior de la célula», afirma Llorca.
Los grupos de los expertos Víctor Guallar (Centro de Supercomputación de Barcelona) y Lucía Díaz (Nostrum Biodiscovery) realizaron estas predicciones sobre el funcionamiento del transportador que fueron testadas por Rullo-Tubau, mediante la medición del efecto de mutaciones específicas en la Asc-1. Estos trabajos fueron complementados por Rafael Artuch (Hospital Sant Joan de Déu) y la plataforma científica de Bioestadística y Bioinformática del IRB Barcelona, que lidera Camille Stephan-Otto Attolini.
Una proteína con dos modus operandi
Las conclusiones contribuyen a explicar otra particularidad del Asc-1. Si bien el resto de la familia de transportadores a los que pertenece —llamada HAT— solo pueden intercambiar aminoácidos —es decir, transportar un aminoácido hacia dentro de la célula cuando sacan otro o viceversa—, el Asc-1 es capaz de extraer un aminoácido sin necesidad de introducir otro y abrirse y cerrarse de vacío. Este modo de actividad se llama difusión.
Los resultados obtenidos sobre la estructura molecular del Asc-1 aportan datos para comprender mejor la función que realiza cada uno de los modos de transporte. La financiación del nuevo estudio procede mayoritariamente de la Fundación La Caixa y el Ministerio de Ciencia, Innovación y Universidades (Implicación en enfermedades neurológicas).
Artículo de referencia:
Rullo-Tubau, Josep; Martínez-Molledo, Maria et al. «Structure and mechanisms of transport of human Asc1/CD98hc amino acid transporter». Nature Communications, abril de 2024. Doi: 10.1038/s41467-024-47385-3.
Galería multimedia

De izquierda a derecha, Manuel Palacín, Josep Rullo-Tubau y Paola Bartoccioni.