Descobert un mecanisme que explica la falta dʼeficàcia de determinats fàrmacs antagonistes
Membres del Grup de Recerca Consolidat de Neurobiologia Molecular del Departament de Bioquímica i Biologia Molecular de la UB, vinculat al Centre dʼInvestigació Biomèdica en Xarxa sobre Malalties Neurodegeneratives (CIBERNED), ha publicat un treball a la revista Proceedings of the National Academy of Sciences (PNAS) sobre la formació de complexos entre receptors acoblats a proteïnes G (GPCR) que permet explicar certs comportaments inesperats de determinats fàrmacs antagonistes (que bloquegen respostes fisiològiques).

Membres del Grup de Recerca Consolidat de Neurobiologia Molecular del Departament de Bioquímica i Biologia Molecular de la UB, vinculat al Centre dʼInvestigació Biomèdica en Xarxa sobre Malalties Neurodegeneratives (CIBERNED), ha publicat un treball a la revista Proceedings of the National Academy of Sciences (PNAS) sobre la formació de complexos entre receptors acoblats a proteïnes G (GPCR) que permet explicar certs comportaments inesperats de determinats fàrmacs antagonistes (que bloquegen respostes fisiològiques).
El treball, dut a terme amb rates de laboratori i línies cel·lulars humanes, ha estat dirigit pels experts Vicent Casadó i Enric I. Canela, del Departament de Bioquímica i Biologia Molecular (Biologia) i del Grup de Recerca de Neurobiologia Molecular de la UB, i també hi han intervingut els experts de la UB Jordi Bonaventura, Verònica Casadó, Gemma Navarro, Estefania Moreno, Marc Brugarolas, Carme Lluís, Josefa Mallol i Antoni Cortés. En lʼestudi hi han col·laborat els grups de recerca dels experts Sergi Ferré (Institut Nacional sobre lʼAbús de Drogues, Estats Units), i Serge Schiffmann (Universitat Lliure de Brussel·les, Bèlgica).
Fàrmacs potencials per combatre la malaltia de Parkinson
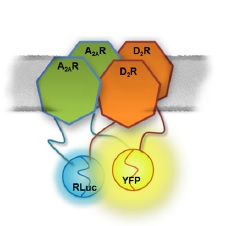
En concret, lʼequip ha determinat que els receptors A2A dʼadenosina sʼassocien amb els D2 de dopamina formant una estructura tetramèrica (un homòmer dʼA2A més un homòmer de D2). Aquesta associació produïda als ganglis basals del cervell era coneguda però no així la seva estructura concreta, i és un dels mecanismes implicats en el control fi del moviment. El funcionament incorrecte és responsable dʼimportants problemes locomotors que es tradueixen en hipo o hipercinèsies (alteracions de moviments) que són típiques de patologies com el Parkinson, lʼesquizofrènia o la malaltia de Huntington. Tot considerant la interacció entre aquests receptors, sʼhan proposat els antagonistes dels receptors A2A com a potencials fàrmacs per combatre la malaltia de Parkinson.
Com a descoberta més significativa, lʼarticle publicat al PNAS descriu que lʼestructura tetramèrica del complex format per aquests receptors permet explicar les discrepàncies trobades en administrar aquests fàrmacs antagonistes ja que de vegades produeixen activació motora i, en altres ocasions, aguditzen la inhibició motora.
Més enllà del model tradicional agonista-antagonista
El model tetramèric descobert pels autors del treball permet explicar com és que, a determinades concentracions dʼun fàrmac antagonista dels receptors dʼadenosina A2A —per exemple, la mateixa cafeïna, ingerida per una part important de la població—, aquest es comporta com a tal i bloqueja els efectes inhibidors del moviment produïts per lʼadenosina formada de manera endògena pel cos humà. A dosis superiors, lʼantagonista podria deixar de bloquejar lʼefecte de lʼadenosina endògena i mimetitzaria el paper de la mateixa adenosina, tot disminuint la funció dels receptors D2 de dopamina, de manera que deixaria de ser un fàrmac efectiu i passaria a ser un fàrmac perjudicial per al control motriu. Aquest fet contravé el punt de vista tradicional que descriu els antagonistes com a lligands inactius que tan sols competeixen amb els agonistes endògens en la unió al receptor a fi de bloquejar-ne lʼactivitat intracel·lular.
Estudiant les bases fisiològiques de les addicions
Els resultats dʼaquest treball poden extrapolar-se a lʼefecte que puguin tenir els fàrmacs antagonistes sobre altres receptors que també sʼassocien formant heteròmers, com ara els responsables dels processos addictius a drogues, aliments i altres substàncies. De fet, sʼha comprovat lʼassociació entre molts receptors de la família GPCR que formen heteròmers amb unes noves propietats farmacològiques i funcionals, diferents de les dels receptors individuals.
Tal com detalla aquest equip investigador de la UB, que és pioner en lʼestudi dʼaquestes interaccions, «el fet que altres receptors dʼhormones, de neurotransmissors i de neuromoduladors sʼassociïn formant tetràmers permetria explicar resultats contradictoris en les teràpies basades en lʼús dʼun fàrmac antagonista dʼun receptor per alterar el funcionament de lʼaltre receptor associat, i posa de manifest que lʼèxit dʼaquest tipus de tractaments es basa en la correcta dosificació del fàrmac».
Cepero, Álvaro; Navarro, Gemma; Casadó-Anguera, Verònica; Azdad, Karima; Brugarolas, Marc; Mallol, Josefa; Canela, Enric I.; Lluís, Carme; Cortés, Antoni; Volkow, Nora D.; Schiffmann, Serge N.; Ferré, Sergi; Casadó, Vicent. «Allosteric interactions between agonists and antagonists within the adenosine A2A receptor-dopamine D2 receptor heterotetramer». Proceedings of the National Academy of Sciences, juliol de 2015, vol. 112. DOI: 10.1073/pnas.1507704112